Karbonylki: Różnice pomiędzy wersjami
imported>Michał Ski m drobne redakcyjne |
(Brak różnic)
|
Aktualna wersja na dzień 08:37, 21 lip 2023
Karbonylki – nieorganiczne związki kompleksowe, w których ligandem jest tlenek węgla, stosowane w chemii metaloorganicznej. Nazwę karbonylek stosuje się także na określenie samego ligandu karbonylkowego, CO (nie należy mylić go z organiczną grupą karbonylową).
Pierwszy związek zawierający ligandy karbonylkowe został otrzymany przez Ludwiga Monda w 1888 r. Zauważył on, że tlenek węgla reaguje z niklem, tworząc związek o zadziwiająco niskiej temperaturze wrzenia (43 °C)Szablon:Odn[1], który po podgrzaniu do ok. 100 °C rozkłada się ponownie do niklu i tlenku węgla:
Po kilku latach badań Mond zastosował proces syntezy, destylacji i rozkładu termicznego tetrakarbonylku niklu do otrzymywania bardzo czystego niklu w swojej hucie w Walii. Proces ten do dziś jest z powodzeniem stosowany przy produkcji tego metalu. Wkrótce potem Mond, a także – niezależnie od niego – Bertholet, otrzymali w podobny sposób Fe(CO)5. natomiast karbonylki innych metali najlepiej jest otrzymywać w reakcji ich soli z CO w warunkach redukującychSzablon:Odn.
Tlenek węgla ma wolną parę elektronową na atomie węgla i jest w związku z tym słabą zasadą Lewisa. Słabe zasady Lewisa zwykle nie reagują z metalami na zerowym stopniu utlenienia. Jednak wiązanie Szablon:Chem2 jest stabilizowane przez szczególny układ orbitali molekularnychSzablon:Odn:
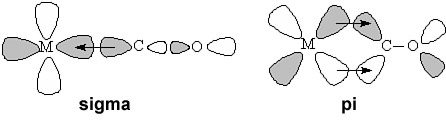
Wiązanie σ jest wiązaniem koordynacyjnym, w którym funkcję donora elektronów pełni karbonylek – samo w sobie jest ono jednak energetycznie niekorzystne i, jak dowodzą obliczenia kwantowo-mechaniczne, jest ono właściwie lekko antywiążące. Cały układ jest dopiero stabilizowany przez wiązania π między orbitalami sp tlenku węgla i orbitalami d metalu, przy czym rolę donora elektronów odgrywa tu metal, a nie karbonylek (jest to przykład tak zwanego „wiązania zwrotnego”)Szablon:Odn.
Wiązanie metal-karbonylek jest jednak względnie słabe. Ligand karbonylkowy można bardzo łatwo oderwać od metalu – dzięki czemu łatwo wymienia się go na inne ligandy (L')Szablon:Odn:
Dość łatwo można też wyeliminować jeden lub więcej ligandów karbonylkowych i otrzymać bardzo stabilne aniony o wysokiej zasadowościSzablon:Odn:
Z kolei aniony te są czynnikami nukleofilowymi, z których można otrzymać wodorki karbonylkoweSzablon:Odn:
które są kwasami protonowymi, o zróżnicowanej mocy (np.: Szablon:Chem2 ma pKa = 1), przy czym atom wodoru jest w nich ligandem atomu centralnego i może zostać wymieniony na inny ligand, np.Szablon:Fakt:
Labilne własności karbonylków metali, połączone z łatwością ich syntezy, są one bardzo często podstawowym, wyjściowym substratem do otrzymywania wielu związków metaloorganicznych. Łatwość zrywania i tworzenia wiązań metal-karbonylek jest też bardzo przydatna w katalizie i dlatego ogromna większość katalizatorów metaloorganicznych zawiera zwykle przynajmniej jeden ligand tego rodzaju – kompleksy czysto karbonylkowe są jednak zbyt reaktywne, aby same pełnić tę rolę. Wyjątek stanowi Szablon:Chem2, który był stosowany w latach 1925–1945 jako dodatek przeciwstukowy do benzyny w Niemczech i krajach okupowanych przez Niemcy w czasach II wojny światowejSzablon:Fakt.